ブログ
【ヘルスケア】人を対象とする医学研究に関する主要な法令・指針等について
2023.08.23
はじめに
人を対象とする医学研究については、数多くの法令や指針等が存在し、研究の場面(目的)や内容によって適用されるルールに違いが生じることになります。
例えば、人を対象とする医学研究に適用される代表的な法律として、以下のものがあります。
|
・医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 ・再生医療等の安全性の確保等に関する法律 ・臨床研究法 |
また、これらの法律が適用されない場面でも、ルールがないというわけではなく、人を対象とする医学研究全般に適用されるルールとして、国際的な倫理的原則である「ヘルシンキ宣言 人間を対象とする医学研究の倫理的原則」(本稿執筆時点では2013年のフォルタレザ改訂のものが最新のもの。以下「ヘルシンキ宣言」といいます。)が存在しますし、研究内容や研究に用いる試料・情報の特徴に応じた個別具体的なルールとして、人を対象とする生命科学・医学系研究に関する倫理指針(以下「生命・医学系指針」といいます。)等の7つの指針等が公表されています[1]。
上記で挙げたもの以外にも、研究の場面(目的)や内容に応じて様々な法令(個人情報保護法等)や指針が適用されます。
そして、このような各種ルールに違反してしまった場合、①最悪の場合には刑事罰が科され、また、②研究費に充てた補助金の交付決定の取り消しを受ける可能性があるとともに、③大臣への事実関係等の報告・公表、被験者等への説明等を行わなければならず、結果として、研究の進行や論文の公表に支障が生じる可能性があるなど、様々な不都合が生じる可能性があります。
そこで、本稿では、研究に関するルールを遵守する前提として、各研究にどのようなルールが適用されるのかを把握するために、人を対象とする医学研究に関連する主要な法令や指針等を適用場面に応じて分類し、その概要を説明します。
なお、以下では、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律を「薬機法」と、再生医療等の安全性の確保等に関する法律を「再生医療等安全性確保法」といいます。
研究の場面(目的)と内容に応じた適用関係の概要
人を対象とする医学研究に関連する主要な法令や指針等の適用関係は、研究の場面(目的)や内容に応じて異なります。その概要を図で整理すると、以下のとおりです。
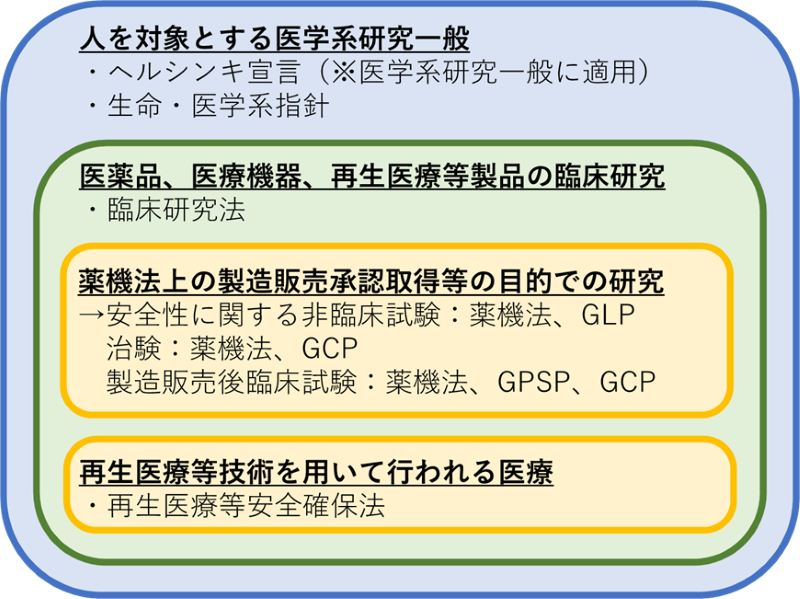
それぞれの法令・指針等の内容について、以下概説します。
1.人を対象とする医学研究一般に適用されるもの(ヘルシンキ宣言)
ヘルシンキ宣言は、1964年に世界医師会が作成した、人を対象とする医学研究の倫理的原則です。ヘルシンキ宣言は主に医師に対して表明された宣言であるものの、世界医師会は、人間を対象とする医学研究に関与する医師以外の人々に対しても同宣言の原則の採用を推奨しています(ヘルシンキ宣言第2条)。
ヘルシンキ宣言は、被験者の権利・利益の優先、リスクの最小化、インフォームド・コンセント等の基本原則を定めたもので、法律・指針の有無にかかわらず、人を対象とする医学研究を実施する医師は、ヘルシンキ宣言の趣旨を十分に理解して、これを遵守する必要があります。
2.人を対象とする医学研究の一部に適用されるもの
(1) 薬機法上の製造販売承認取得・維持等の目的での研究(薬機法関連法令)
薬機法上の製造販売承認取得・維持等の目的での研究には、薬機法関係の法令が適用されます。以下のとおり、安全性に関する非臨床試験ではGLP省令が、治験では薬機法及びGCP省令が、製造販売後臨床試験ではGPSP省令及びGCP省令が、主に適用されます。なお、これら以外にも、承認申請書に添付すべき資料の編集方法及び当該資料を作成するための試験の指針等について、医薬品規制調和国際会議(ICH)や厚生労働省等により、様々なガイドラインやガイダンスが作成されています。
ア 安全性に関する非臨床試験(GLP省令)
医薬品、医療機器及び再生医療等製品(以下、総称して「医薬品等」といいます。)の製造販売承認申請の添付資料等の収集及び作成の基準のうち、医薬品等の安全性に関する非臨床試験の一部に係るものについては、承認申請の対象となる製品に応じて、以下のGLP省令が適用されます。
|
・医薬品の安全性に関する非臨床試験の実施の基準に関する省令(医薬品GLP省令) ・医療機器の安全性に関する非臨床試験の実施の基準に関する省令(医療機器GLP省令) ・再生医療等製品の安全性に関する非臨床試験の実施の基準に関する省令(再生医療等製品GLP省令) |
イ 治験(薬機法、GCP省令)
「治験」とは、製造販売承認の申請書の添付資料等のうち、臨床試験の試験成績に関する資料の収集を目的とする試験の実施をいいます(薬機法第2条第17項)。治験には、薬機法が適用されるとともに、承認申請の対象となる製品に応じて、以下のGCP省令が適用されます。
|
・医薬品の臨床試験の実施の基準に関する省令(医薬品GCP省令) ・医療機器の臨床試験の実施の基準に関する省令(医療機器GCP省令) ・再生医療等製品の臨床試験の実施の基準に関する省令(再生医療等製品GCP省令) |
ウ 製造販売後臨床試験(GPSP省令、GCP省令)
「製造販売後臨床試験」とは、治験、使用成績調査若しくは製造販売後データベース調査の成績に関する検討を行った結果得られた推定等を検証し、又は診療においては得られない品質、有効性等に関する情報を収集するため、薬機法の承認に係る用法等に従い行う試験をいいます(医薬品の製造販売後の調査及び試験の実施の基準に関する省令第2条第1項3号等)。製造販売後臨床試験には、上記イの各GCP省令が適用されるとともに、以下のGPSP省令が適用されます。
|
・医薬品の製造販売後の調査及び試験の実施の基準に関する省令(医薬品GPSP省令) ・医療機器の製造販売後の調査及び試験の実施の基準に関する省令(医療機器GPSP省令) ・再生医療等製品の製造販売後の調査及び試験の実施の基準に関する省令(再生医療等製品GPSP省令) |
(2) 再生医療等技術を用いて行われる医療に該当する研究(再生医療等安全確保法)
再生医療等技術を用いて行われる医療(薬機法第80条の2第2項に規定する治験に該当するものを除き、以下「再生医療等」といいます。)に該当する研究には、再生医療等安全確保法が適用されます。
なお、再生医療等技術とは、次の医療に用いられることが目的とされている医療技術であって、細胞加工物を用いるもの(細胞加工物として再生医療等製品のみを当該承認の内容に従い用いるものを除く。)のうち、その安全性の確保等に関する措置その他のこの法律で定める措置を講ずることが必要なものとして政令で定めるものをいいます(再生医療等安全確保法2条2項)。
① 人の身体の構造又は機能の再建、修復又は形成
② 人の疾病の治療又は予防
(3) その他の医薬品等の安全性・有効性確認目的の研究(臨床研究法)
その他の医薬品等の安全性・有効性確認目的での研究には、臨床研究法が適用されます。臨床研究法が適用される「臨床研究」とは、「医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究」(治験、製造販売後臨床試験やいわゆる観察研究に該当するもの等を除きます。)をいいます(臨床研究法第2条第1項、臨床研究法施行規則第2条)。ただし、臨床研究の実施に係る規定を定める臨床研究法第2章(第3条乃至第22条)は、臨床研究のうち、医薬品等を用いることが再生医療等に該当する場合には、再生医療等安全性確保法が適用され、臨床研究法は適用されません(同法第22条)。
臨床研究のうち、特定臨床研究については、臨床研究法施行規則で定められた臨床研究実施基準に従って実施する必要があります。特定臨床研究には、薬機法における未承認・適応外の医薬品等の臨床研究、及び医薬品等製造販売業者から資金提供を受けて行われる当該医薬品等を使用する臨床研究が含まれます(臨床研究法第2条第2項)。その他の臨床研究については、臨床研究実施基準に従って実施するよう努める必要があります(同1項)。
(4) その他の人を対象とする生命科学・医学系研究(生命・医学系指針)
文部科学省・厚生労働省・経済産業省告示である、「人を対象とする生命科学・医学系研究に関する倫理指針」(以下「生命・医学系指針」といいます。)が適用される生命科学・医学系研究とは、次のア又はイを目的として実施される活動をいいます(生命・医学系指針第1章第2の1(1))。
|
ア 次の①、②、③又は④を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること |
ただし、次に掲げるアからウまでのいずれかに該当する研究は、生命・医学系指針の対象となりません(生命・医学系指針第1章第3の1)。
|
ア 法令の規定により実施される研究 |
そして、上記(1)から(3)の研究は、原則として、このうちのイ(法令の定める基準の適用範囲に含まれる研究)として、生命・医学系指針は適用されないと考えられます(人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス、37頁)。
まとめ
上記のとおり、本稿では、人を対象とする医学研究に関連する主要な法令や指針等を適用場面に応じて分類し、その概要を説明いたしました。今後、本ブログにおいて、各種法令・指針等について概要をご説明させていただきますのでご期待ください!
[1] 人を対象とする生命科学医学系研究に関する倫理指針、遺伝子治療等臨床研究に関する指針、手術等で摘出されたヒト組織を用いた研究開発の在り方、厚生労働省の所管する実施機関における動物実験等の実施に関する基本指針、異種移植の実施に伴う公衆衛生上の感染症問題に関する指針、ヒト受精胚の作成を行う生殖補助医療研究に関する倫理指針、ヒト受精胚に遺伝情報改変技術等を用いる研究に関する倫理指針の7つが記載されています。なお、過去に存在した、「人を対象とする医学系研究に関する倫理指針」、「ヒトゲノム・遺伝子解析研究に関する倫理指針」、「疫学研究に関する倫理指針」、「臨床研究に関する指針」、及び「ヒト幹細胞を用いる臨床研究に関する指針」については、既に廃止されています。


