ブログ
後発医薬品に対して延長後の特許権が行使され計約217億円の損害賠償が命じられた知財高裁判決の事例(レミッチ®事件)
2025.12.02
はじめに
本件知財高裁判決 (2025年5月27日(令和3年(ネ)第10037号)/通称「レミッチ® 事件」)は、先発医薬品会社が、特許期間延長登録がされた特許権を、後発医薬品に対して権利行使した、特許権侵害に基づく損害賠償請求事件で、原審の地裁判決を覆して侵害を認定し、後発メーカーである被告らに損害合計約217億円及び遅延損害金という巨額の支払いが命じられ注目を集めた事案である。
本判決で判示された論点は、「有効成分」という文言のクレーム解釈のほか、特許期間延長後の特許権の効力範囲の判断、特許期間延長登録時の延長期間の考え方などにかかる論点を含む。
事案の概要
原告且つ控訴人(以下「原告」という。)は特許権者であり、先発医薬品の製造販売業者である。
原告は、被告ら(且つ被控訴人ら。以下「被告ら」という。)が行う後発医薬品の製造、販売等が、存続期間の延長登録がされた特許第3531170号(以下「本件特許」)を侵害すると主張して、被告らに対して損害賠償請求をした。
本件で問題になっている本件特許の請求項1の発明(「本件発明」)は次のとおりである:
【請求項1】
“一般式(I)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤”
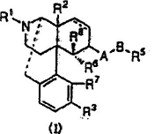
ここで、式(I)では、ナルフラフィンという化学物質のフリー体が構造式で描かれている。
原告の先発医薬品(以下「原告製剤」)は、レミッチ®OD錠2.5㎍(添付文書での記載は「有効成分:1錠中 ナルフラフィン塩酸塩2.5㎍(ナルフラフィンとして2.32㎍)」)である。
本件特許には、原告製剤に付された2017年3月30日付の製造販売承認処分(「本件承認」)に基づく存続期間延長の登録(特願2017-700154)(「本件延長登録」)がある。これにより、特許期間(延長前の満了は2017年11月)が約4年11カ月延長されたが、延長後の特許期間も本件高裁判決までには終了しており、差止請求は取り下げられた。
被疑侵害製品(以下「被告製剤」)は、原告製剤の後発医薬品である、「ナルフラフィン塩酸塩OD錠2.5㎍『被告ら各会社名』」(添付文書での記載は「有効成分[1錠中]:ナルフラフィン塩酸塩2.5㎍(ナルフラフィンとして2.32㎍))である。
一審判決では侵害が認められず原告敗訴であったのに対し、原告が控訴したのが、本件の知財高裁事件である。
第一審判決では侵害が否定された
当事者らの主張においては、延長された特許権の効力範囲等を含む、諸々の論点が争われていたが、第一審である東京地裁は、特許のクレームする権利範囲の解釈について
- クレームにいう「有効成分」とは、添加剤を加えて製剤として組成される基となる原薬のことをいうものと解釈すべきであり、すなわちナルフラフィンのフリー体を原薬とする止痒剤が本件発明である
- ナルフラフィンの塩フォームを原薬とする製剤は本件発明としてクレームされた範囲に含まれない
との考え方を採用したうえで、ナルフラフィン塩酸塩を原薬としてこれに添加剤を加えて組成した被告製剤はそもそも本件発明のクレームする範囲内に入らないと判断し、非侵害・請求棄却の判断を下した。(東京地裁2021年3月30日)
すなわち一審裁判所は、各種証拠文献の記載に基づいて、医薬品分野において製剤は、主に単一成分の結晶であるフリー体又は複合成分の結晶である水和物及び塩の形態をとっている原薬を有効成分として、これに添加剤を加えて組成されたものをいう、と理解した上で、これをふまえると、「止痒剤」という製剤を組成する「有効成分」に関する発明である本件特許明細書の記載に接した当業者は、通常、「有効成分」とは、添加剤を加えて製剤として組成される基となる原薬のことをいうものと理解する、と述べて、文言侵害の成立を否定した。
また、均等侵害についても、「明細書には本件発明に記載された本件化合物のほかに、その薬理学的に許容される酸付加塩が挙げられることが明記されているほか、同化合物に対する薬理学的に好ましい酸付加塩の具体的態様(塩酸塩,硫酸塩,硝酸塩等)も明示的に記載されている」と述べ、塩フォームはクレーム範囲から意識的に除外されている(均等侵害成立の第五要件を欠く)と判断して、原告の侵害主張を退けた。
侵害を認めた知財高裁判決
これに対して知財高裁は、
- 被告製剤は本件発明の技術的範囲に属する
- 本件延長登録による存続期間延長後の本件特許権の効力は被告製剤の製造販売等に及ぶ
- 本件延長登録が無効にされるべきものともいえない
などと判断し、原審の判断を覆して本件特許権の侵害を認めた。
以下5~7で、各ポイントについて知財高裁が本件判決で示した判断内容を詳述する。
クレーム文言「有効成分」についての知財高裁の解釈
本件知財高裁判決は、クレームの「有効成分」という文言は、「体内(血中)で溶出し作用する物質の意味」とする解釈をとった。
知財高裁はこの理由として、要するところ以下(i)~(v)のように述べている。
(i) 請求項1には、「κ受容体作動性化合物又はその塩」を有効成分とするという表現は用いられていない。しかし、本件明細書には、「オピオイドκ受容体作動薬」は、「オピオイドκ受容体作動性を示すモルヒナン誘導体またはその薬理学的に許容される酸付加塩」であり、「一般式(I)で表されるオピオイドκ受容体作動性化合物」、その「酸付加塩」…等の記載がある。また、本件明細書の実施例9においても、「選択的なκ受容体作動性オピオイド化合物である…モルヒナン塩酸塩7」と記載されており、「化合物」と「その酸付加塩」の形態とは厳密に区別されていない。
(ii) 「有効成分」という用語は、各種証拠文献の記載によれば、本件特許出願の日の前後を通じて、体内(血中)で溶出し薬理作用を発揮する化学物質の意味で用いられる場合が一般的に見られていた。本件明細書にもこれと異なる解釈をとるべき理由は見当たらない。
(iii) 確かに、製剤開発の観点から、最終的に所望の溶解度、安定性を得るために塩の形態にしたものを原薬とし、配合目的が添加剤である構成成分と区別するために、塩形態を含めて「有効成分」と呼ぶ取扱いが存在することは認められる。しかし、付加された塩の部分が体内で薬理作用を発揮する化学物質になるわけではない。
(iv) もともと、本件発明の目的は、止痒作用が極めて速くて強いオピオイドκ受容体作動薬及びこれを含んでなる止痒剤を提供することである。各種証拠文献の記載によれば、製剤分野において、本件特許の出願当時、薬物の溶解性や安定性を向上させるために酸付加塩の形態をとることは技術常識だったと認められる。本件明細書の記載によっても塩形態にそれ以外の技術的意義があるとは認められない。したがって、本件明細書をみた当業者は、本件発明の目的である止痒作用を発揮する化学物質は「κ受容体作動性化合物」であって、塩形態は、物質の止痒作用自体を変化させるためのものではなく、薬としての溶解性や安定性を向上させるための形態にすぎないことは容易に理解できたはずである。そうすると、製剤開発分野や薬事承認に際して、化合物とその塩とを含めて「有効成分」と呼んで添加剤と区別する場合があることを踏まえたとしてもなお、当業者において、請求項1に「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」とだけ記載されていることを理由に、その趣旨が、塩形態は本件発明の「有効成分」には当たらず特許の技術的範囲外であると解釈するとは考えられない。止痒剤に関する特許において、合理的理由もなくわざわざ塩形態という、薬の溶解性や安定性を向上させるために通常よく用いられる構成を除外してクレーム範囲を決めることは不自然である。むしろ、本件明細書の記載によれば、塩形態はκ受容体作動性化合物を有効成分とする止痒剤の実施形態の一つだと容易に理解される。
(v) 本件特許の出願経過を参酌しても、請求項1から「酸付加塩」の文言を意識的に除外したという事情は認められない。
ここで(v)に関し、出願経緯について補足説明しておく。補正前の請求項1~3は次のようであった。
旧・請求項1: 「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」
旧・請求項2: 「オピオイドκ受容体作動性化合物がモルヒナン誘導体またはその薬理学的に許容される酸付加塩である請求項1の止痒剤」
旧・請求項3: 「モルヒナン誘導体が下記一般式(I)(…) であらわされるものである請求項2記載の止痒剤」
補正により、旧請求項1と2が削除され、旧請求項3が現請求項1(本件発明)に補正された。この際に「またはその薬理学的に許容される酸付加塩」の文言が欠落させられたのであるが、本件知財高裁判決は、補正前の請求項3(現請求項1)は拒絶の対象にされておらず、また出願人の意見書にも補正後請求項1において「またはその…塩」の文言を欠落させたことについての説明はされていない、として、意識的な除外は認められないと判断した。
以上、クレームや特許明細書の記載、特許出願経過、及び出願当時の技術常識をふまえた結論として、知財高裁は、本件発明は、塩形態をとるか否かにかかわらず、一般式(Ⅰ)で表される化合物が生体内において溶出して吸収されそのオピオイドκ受容体作動性という属性に基づいて「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解するのが相当だと述べ、したがって、被告製剤は、ナルフラフィンが(塩酸塩の形態で配合されているのではあるが)生体内で溶出して吸収されオピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏する止痒剤であり、本件発明のクレームする技術的範囲に属すると判断した。
延長された特許権の効力範囲に関する知財高裁の判断
本件特許権には本件期間延長登録が付されている。上述のように、被告製剤がクレームの技術的範囲内に入ると解釈されたとしても、延長後の特許権の及ぶ範囲は、特許法68条の2の規定により限定されることになる。そのため、次のステップとして、その制限された権利範囲を検討する必要がある。
特許期間延長の仕組みと、延長後の特許の権利範囲に関する判断基準を示した従前の裁判例に言及した上で、本件知財高裁判決の判断内容を説明する。
(1) 特許期間延長について
特許法67条4項は、特許期間は、「その特許発明の実施について法律の規定する許認可等の処分であって政令が指定するものを得る必要があるために発明の実施をできない期間」があった場合に、最大5年の延長を認める。医薬品の製造販売承認は、政令が定めるそのような許認可処分の一つである。
日本の特許期間延長制度の特徴として、以下の点がある。
i) 延長は、各承認処分に基づいて申請され登録される。
ii) ひとつの特許権に複数の特許期間延長が付与されることができる。(例えば、ある医薬品の新規の承認、追加効能にかかる承認、それぞれの承認処分に基づいた、2つの特許期間延長登録が可能。)
iii) また一つの承認処分に基づき、複数の特許権について延長登録をすることができる。
iv) 延長された特許権の効力は、クレームされた範囲の全てに及ぶのではなく、制限される。すなわち、特許法68条の2によれば、「存続期間が延長された場合…の当該特許権の効力は、その延長登録の理由となった…政令で定める処分の対象となった物 (その処分においてその物の使用される特定の用途が定められている場合にあっては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない」とされている。医薬品に関する場合ここにいう「政令で定める処分」は製造販売承認処分である。
(2) 2017年知財高裁大合議判決(オキサリプラチン事件)が示した延長後特許権の効力範囲の判断基準
医薬品について、特許法68条の2で限定される延長後特許権の効力範囲については、2017年の知財高裁大合議判決が次のような解釈を示している(知財高判2017年1月20日、平成28年(ネ)第10046号 (通称「オキサリプラチン事件」))。
i) 延長された特許権は、特許権延長登録の基となった承認処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」についての「当該特許発明の実施」の範囲で効力が及ぶ、のみならず、
ii) それと医薬品として「実質的に同一」である製品にも及ぶ。
そしてこの2017年知財高裁大合議判決は、特許発明が、医薬品の成分を対象とする物の発明である場合において、延長処分の対象となった製品と被疑侵害製品との差が、「成分」の差異、又は「分量」もしくは「用法、用量」の数量的差異の、いずれか 1又は複数であるが、それ以外の差異が存在しないという限られた場合に関していえば、実質的同一性は、特許発明の内容との関連で技術的特徴と作用効果の同一性を比較検討して当業者の技術常識を踏まえて判断すべきとしつつ、「実質的に同一」ということのできるパターンとして次の4類型を例示した。
① 医薬品の有効成分のみを特徴とする特許発明において、有効成分でない成分に関して、対象製品が、承認申請時の周知・慣用技術に基づいて一部異なる成分を付加、転換等しているような場合
② 公知の有効成分に係る医薬品の安定性ないし剤型に関する特許発明において、対象製品が承認申請時の周知・慣用技術に基づいて一部異なる成分を付加、転換等しているような場合で、特許発明の内容に照らして、承認対象として特定された製品と対象製品の間で、その技術的特徴及び作用効果の同一性があると認められるとき
③ 承認処分で特定された「分量」ないし「用法、用量」に関し、数量的に意味のない程度の差異しかない場合
④ 承認処分で特定された「分量」は異なるが、「用法、用量」も併せてみれば同一と認められる場合
(3) 本件判決における知財高裁の判断
本件事案において、原告製剤と被告製剤とを比較すると、有効成分とその分量はいずれもナルフラフィン塩酸塩 2.5㎍で共通しており、用法・用量、効能・効果、またOD錠(口腔内崩壊錠(口内に入れると容易に崩壊し水無しでも服用可能な錠剤))という剤形も、両者共通である。一方、添加剤は異なる組み合わせのものが使われている。
本件知財高裁判決は、延長後の特許権の効力が及ぶ範囲には、原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が同一のものに加えて、実質的に同一と認められるものも含まれるというべき、という上記2017年知財高裁大合議判決が示した判断の枠組みを踏襲した。その上で、以下のように述べて、被告製剤は、「成分」(添加剤)上の差異にかかわらず原告製剤と実質的に同一であり、延長後の本件特許権の効力が被告製剤の製造販売に及ぶと判断した。
i) 知財高裁は、本件発明を、出願当時既に公知の物質であった「一般式(Ⅰ)で表されるκ受容体作動性化合物」について、その止痒剤としての作用効果を有する有効成分として用いた用途発明である点に技術的特徴があると把握した。そのうえで、特許法68条の2で限定される延長後特許の権利範囲解釈における、「実質的に同一」の範囲の判断基準として、以下を提示した。
被告製剤が、原告製剤とナルフラフィンを有効成分とする止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形を同一にする場合において、次のaやbの場合は、医薬品としては、本件承認の対象となった原告製剤と実質同一なものに該当するというべきである:
a. 被告製剤が、有効成分ではない成分に関して、承認申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているにすぎないと認められるときや、
b. 有効成分以外の被告製剤との「成分」等の差異が医薬品としての「効能及び効果」に影響を与えず、当該差異が僅かな差異又は全体的にみて形式的な差異にすぎないと認められるとき
ii) 知財高裁は、被告製剤と原告製剤との相違点である添加剤に関して、次の旨述べて、被告製剤は医薬品として本件承認処分の対象となった原告製剤と実質同一なものに該当するというべきとした。
- 各種文献によれば、添加剤は薬理作用を示さず、かつ、有効成分の治療効果を妨げるものではないことは技術常識である。
- 本件発明のクレームは止痒剤に含有される添加剤については何ら特定していない。特許明細書においても、κ受容体作動薬を経口又は非経口的に投与するに際して担体や賦形剤などと混合した医薬組成物とする旨や、経口剤におけるκ受容体作動薬の含量の記載がある程度である。
- 原告製剤と被告製剤は、ナルフラフィンを有効成分とする前記用途の止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形も同一である。原告製剤と被告製剤のこれら共通点や、前記の添加剤の意義に照らすと、原告製剤と被告製剤の添加剤における差異は僅かな差異又は全体的にみて形式的な差異に当たる。
iii) この点に関し、被告らは、被告製剤においては、単なる周知・慣用技術による転用ではなく、製剤中の有効成分の安定性等に着目して被告らが独自に開発した添加物群を適用しているなどと主張して反論していた。しかし、知財高裁は次の旨述べてその主張を排斥した。これは上記iで知財高裁が提示した判断基準の中のbのケースに関するといえるだろう。
- 原告製剤と被告製剤とは、ナルフラフィンを止痒剤の有効成分として用いた経口投与剤であるOD錠という点で、医薬品としての技術的特徴、その作用効果及び剤形が同じである。他方、被告製剤における添加剤は、薬理作用を示さず、無害であり、有効成分であるナルフラフィンの治療効果を妨げないものとして加えられている。
- 被告製剤に、被告らにより独自に開発され、特許出願がされた添加物群が用いられていたとしても、それが薬理作用を有さず、ナルフラフィンの治療効果を妨げない添加剤であることに変わりはないから、これにより原告製剤と被告製剤の医薬品としての特許法68条の2の観点からみた実質同一性が左右されるものと認めるに足りない。
本件延長登録の有効性と期間に関する知財高裁の判断
本件知財高裁判決
被告らは本件訴訟の中で、本件延長登録のそもそもの有効性や、延長されるべき期間についても争っていたが、結論としてはいずれも排斥されている。
特許法のもと、特許期間延長の有効な登録には、「その特許発明の実施に、延長登録申請の基礎となる承認処分を受けることが必要であった」と認められることが必要であり、また延長が認められる期間は「承認処分を受けるために特許発明を実施することができなかった期間」である(特許法67条4項、及び67条の7,1項1号及び3号)。この延長期間は、承認を受けるのに必要な試験を開始した日、又は特許権の設定登録の日の、いずれか遅い方の日に始まり、承認が申請者に到達した日の前日までとされる。
本件延長登録が基礎とした承認処分は、原告製品であるレミッチ®OD錠2.5㎍の承認であるが、これは、既承認医薬品として原告の製品であるレミッチ®カプセル2.5㎍があったのに対する、剤形追加の承認であった。本件延長登録は、①剤型追加承認に際して提出されたカプセル剤との生物学同等性試験に要した期間に、②カプセル剤の承認に際しても審査されOD錠の承認申請でも資料が提出されたカプセル剤を用いた臨床試験の期間もあわせた期間を、延長期間として認めるものであった。本件知財高裁判決は、このような本件延長登録とその延長期間の計算は妥当と判断した。
カプセル錠の承認に基づく別の特許延長登録も付されているところ、そこで既に算入されていた②の期間を算入するのは二重のカウントではないか、などと被告らは主張していた。しかし知財高裁は、②の試験はOD錠に関する本件承認の取得に必要な試験であったこと、実際にその承認申請資料として審査されていること、カプセル錠についての承認があるだけではOD錠の剤型(原告製剤)での本件特許の実施はできなかったことなどを述べ、被告らの主張を排斥した。
紛争の全体像
なお、実際のところ、この紛争の全体像は、本件侵害訴訟に加えて特許庁の審決(複数の期間延長登録に関するものや、特許の無効審判請求事件を含む)とそれに対する知財高裁での審決取消訴訟など、複数の関連事件も並行する複雑なものである。
本件延長登録に関しては、延長登録の有効性に関する特許庁の判断を争う一連の手続も、本件侵害訴訟と別手続きとして存在する。当初特許庁は本件延長登録を拒絶したが、その判断に対する不服が申し立てられた審決取消訴訟において、知財高裁は拒絶を覆し、本件延長登録を認めるべきとした。かかる審決取消判決が出たのは、奇しくも本件侵害訴訟の第一審判決が出た直前(同じ2021年3月)であった。その時点では、侵害事件における判断(一審地方裁判所が示したクレーム解釈)と、延長登録の判断に関する審決取消訴訟で知財高裁が示した判断内容(ナルフラフィン塩酸塩を原薬として含む製品の承認に基づいて本件特許の延長が認められた)とは、整合的に理解するのが難しかったが、本知財高裁判決は、一審を覆して整合的な判断をした。
現在は、本侵害訴訟(侵害を認定)と、これに平行していた本件延長登録の無効審判(被告が申し立てた)の有効審決に対する審決取消訴訟における知財高裁の判決(登録有効)とを争う、最高裁への上告が継続中であるから、法的な最終化・確定はその判断を待つことになる。
まとめ
最高裁の判断による確定を待つ必要があるとしても、本件知財高裁判決の意義の一つは、延長特許権の効力範囲の判断、特に、用途発明に関する場合について、2017年知財高裁大合議判決に加えて判断指針を提供したことにあろう。先発医薬品メーカーが後発医薬品メーカーに対して権利行使をする段階で特許権が延長後の特許期間に入っているケースは多く、また医薬品特許において用途発明のクレームはよく使われることからも、実務的意義は大きいであろう。
一方、クレームの文言解釈については、クレームの他の部分の表現内容、明細書の記載、出願経緯など、個別の事情によっても変わり得るものであるため、本件知財高裁判決が今回示した「有効成分」の解釈をそのまま広く一般化できるわけではない。とはいえ、類似表現を使ったクレームにおける用語解釈や、出願時のクレームや明細書の書き方の実務に影響があり得よう。
著者:弁護士 上野さやか
Member
PROFILE

